由滨海创投投资的天津尚德药缘科技股份有限公司开发的1.1类原创(First in Class)新药ACT001获得美国食品药品管理局(FDA)快速通道资格(Fast Track Designation),用于治疗儿童弥漫性中线神经胶质瘤(DMG),包括但不限于弥漫性内生型桥脑胶质瘤(DIPG)。
美国FDA为了加速当前尚无药可救的危重疾病的药物开发,给予了这类新药优先审批的快速通道资格,为了能使这些药物尽快获批上市,挽救危重病人。尚德药缘的ACT001获得了3项欧美孤儿药资格,1项儿童罕见病资格(中国首个)后,再进一步获得了FDA这项更为重要的临床支持政策与资质。
目前,ACT001已获得全球10余项临床批件,正在中国、澳洲和美国开展临床试验,其中六项为临床2期或者1b/2a,二项为儿童肿瘤1期临床,适应症包括:脑胶质母细胞瘤、儿童弥漫性内生性脑桥胶质瘤(DIPG)、癌症脑转移瘤、视神经脊髓炎与肺纤维化等。目前儿童脑干胶质瘤的II期临床试验,由首都医科大学附属北京天坛医院放疗科邱晓光教授牵头,并在全国10家参研中心开展。ACT001联合全脑放疗用于肺癌脑转移的2b/3期临床试验,由山东第一医科大学附属肿瘤医院的于金明院士牵头,在全国20多家参研中心开展。
ACT001是由南开大学教授陈悦博士的团队创制的新结构小分子化合物,原料为小白菊内酯。小白菊内酯对肿瘤干细胞具有选择性杀灭作用,但它在小白菊中含量极低。陈悦团队发现我国特有植物辛夷(山玉兰)的根皮中小白菊内酯含量高达9.6%,实际提取率稳定在5%~6%。通过半合成手段,该团队对小白菊内酯进行了化学结构改进,获得DMAMCL(即ACT001)。这种小分子化合物口服即可进入血液,并可突破血脑屏障,直接作用于脑部肿瘤病灶。ACT001具有完全自主知识产权,目前已获得二十余个国家的专利授权。
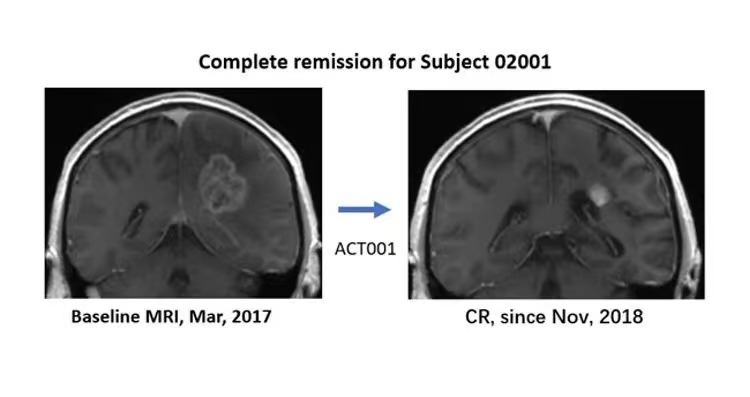
恶性脑胶质瘤是世界医学难题。日前,主持试验的多位中外医生,先后在美国临床肿瘤学会(ASCO)与神经肿瘤学会(SNO)的学术会议上,公布了ACT001的部分临床试验结果:初步证明该候选新药安全、有效,其中一例澳洲复发GBM患者,加入澳洲临床试验,入组时颅内瘤体大小接近4厘米,经过ACT001单药长期治疗,2018年10月达到完全缓解。截至目前,该患者已用药超过六年,依然是完全缓解状态。现在ACT001联合PD-1免疫药治疗复发GBM的临床试验也在进行。左图:复发GBM患者入组前核磁影像(2017年3月),瘤体接近4cm。右图:该患者ACT001单药治疗后的核磁影像,自2018年11月以来,达到完全缓解。
新南威尔士大学悉尼儿童癌症中心的David Ziegler教授团队,在SNO会议上介绍了ACT001治疗儿童弥漫性内生性脑桥胶质瘤(DIPG)的临床试验结果。DIPG属于儿童脑干肿瘤,手术无法切除,没有获批的标准治疗药物,中位生存期不到1年,长期生存率不足1%,是最难治的恶性肿瘤之一。
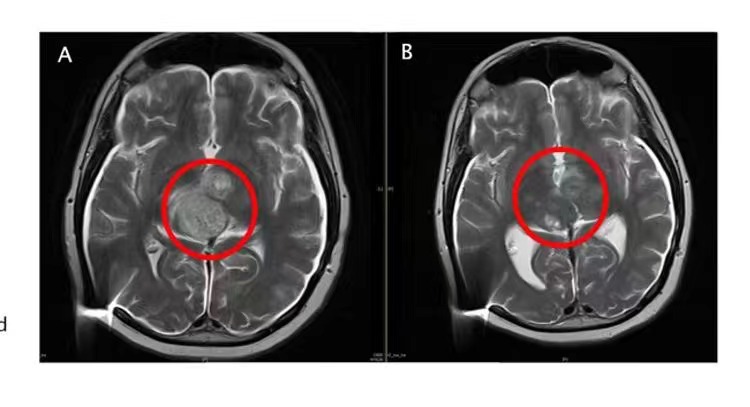
David Ziegler教授团队通过超高剂量的ACT001使二位DIPG或者弥漫性中线胶质瘤DMG患儿身上出现临床反应。其中,一位患者的肿瘤细胞密度大幅降低,临床症状评分(KPS评分)从50提升到90,说明该患者的临床症状与身体状况有大幅好转。
图A:入组前核磁影像,红圈内显示有大量的弥漫性病灶。图B:ACT001单药治疗后影像,肿瘤细胞密度大幅降低。
ACT001的潜在用途不仅局限于脑胶质瘤的治疗,团队还发现ACT001能够提高辐射后动物的生存率,现已申请了其放疗保护的用途专利。
ACT001的成果转化,先后获得国家“十二五”、“十三五”新药创制重大专项与天津市抗癌重大专项的支持。


